
自信獲得醫療器械市場準入
自信獲得醫療器械市場準入
IVDR是目前對于體外診斷醫療器械在歐洲市場投放、提供和投入使用的監管依據。該指令于2017年5月5日發表在《歐盟官方公報》上,并于2017年5月26日生效,逐步取代了歐盟先前的《體外診斷醫療器械指令》(98/79/EC)。
作為歐盟法規,其將在歐盟所有成員國和歐洲自由貿易聯盟成員國內部立即生效,不需要轉換成為各個國家的法律,但可能會采用國家法律來細化一些要求。
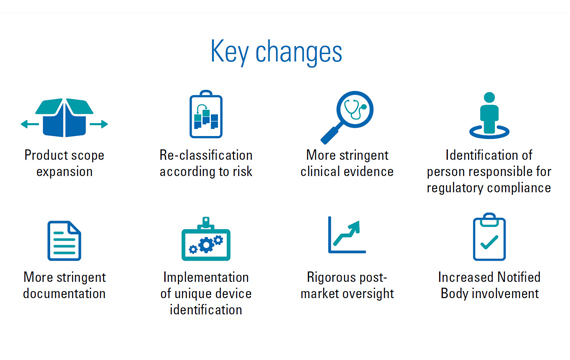
IVDR在很多方面與歐盟關于體外診斷醫療器械現行指令有所不同。法規當中最重要的變化包括:
符合性評估程序
大多數類型的醫療器械開發過程都很復雜,再加上需要應對新的監管要求和獲得公告機構的批準,對大多數設備制造商來說,過渡可能是一個復雜而耗時的過程。另外,目前批準的器械還需遵守新法規要求,而且需要重新評估和審批。
由于制造商需要根據其產品分類申請適用的合格評估程序;本處提供了各個程序的逐步信息指南。
過渡時間表
此外,在歐洲議會和理事會于2022年1月25日發布2022/112號法規(EU)之后,過渡期取決于現行指令和未來法規中IVD器械的類別,以及一些附加條件。


如何做好準備?
盡管IVDR文本已經獲得審批通過,但是仍可以通過法規中規定的實施和授權法案對其進行修改。強烈建議IVD器械制造商始終通過上述法案,關注IVDR修訂內容的最新情況。
對于大多數制造商而言,IVD產品開發過程復雜,再加上需要滿足最新監管要求,并獲得公告機構對更大量產品的審批許可,可能會使新舊規范的過渡變成一個復雜且耗時的過程。另外,目前獲得審批通過的器械也需要滿足最新法規的要求,需要接受重新評估且重新獲得審批。
與此同時,由于絕大多數IVD器械需要接受公告機構審核和審批,必須考慮到公告機構審核和審批過程的時間將會延長。因此,建議制造商與各自的公告機構進行商議,針對目前已經獲得審批通過的器械,評估有關的潛在問題,并盡快制定計劃。為了確保順利過渡到最新要求,必須做好完善的準備,盡早開展行動,這點至關重要。
TÜV南德意志集團如何為您提供幫助?
作為歐盟指令和法規覆蓋范圍內的所有類型醫療器械全球最大的歐盟認證機構,TÜV南德意志集團產品服務公司已成為IVDR的公告機構。新法規對公告機構提出了更嚴格的要求,目前所有公告機構必須獲得新的批準。因此,對于制造商而言,有必要選擇一家在新法規生效后仍然能維持其授權的公告機構。
IVDR常見問題
投放市場意味著器械由制造商或進口商制造并出售給不同的法律實體,但不一定是實際轉讓。任何后續操作,例如從分銷商到最終用戶,都被定義為可用。在市場上投放和在市場上提供可用性都是針對每個單獨的器械而言的,而不是指某一類型的器械,區分的關鍵在于器械是作為一個單獨的單元制造的還是以系列模式制造的。
因此,即使一種型號或類型的器械在IVDR生效日期之前已經在市場供應,該型號或類型的單個器械在在生效日期之后投放市場,也必須符合IVDR的要求。
IVDR對歐盟體外診斷醫療器械的監管要求進行了許多修改。
這些變化將需要制造商大量投入時間、資源、預算以滿足新要求。此外,指導文件、實施細則和授權法案仍有待公布。體外診斷醫療器械的制造商最好了解IVDR的最新修訂內容,并與其公告機構合作,確保在IVDR生效日期之前及時審查和批準制造商器械。
您也可以關注TÜV南德LinkedIn展示頁,獲取關于醫療保健領域及醫療器械的最新信息。
其他資源可在TÜV南德網站上的《體外診斷醫療器械法規》資源中找到。
醫療器械協調小組(MDCG)發布的指導文件可在歐盟委員會網站上查閱。

Following the publication of regulation (EU) 2022/112, the IVDR will be rolled out gradually.
Learn More

A quick guide to the IVDR and what to expect
Learn More

Stay updated on the requirements for devices that were already on the market under IVDD and learn how to transition into IVDR.
Learn More
Site Selector
Global
Americas
Asia
Europe
Middle East and Africa