高效的醫療器械質量管理和測試
高效的醫療器械質量管理和測試
相較絕大部分的產品而言,醫療器械的質量對于其有效性以及患者、用戶等人員的安全將造成更大影響。因此,大部分國家監管計劃要求醫療器械的制造商和供應商建立內部質量管理體系,而且需要經過獨立審核和驗證。組織在質量管理體系未經驗證情況下生產或供應的醫療器械通常會被拒絕,無法合法進入主要市場,這往往會造成市場進入延期和利潤損失。
從2016年12月19日起,TÜV南德產品服務部已經獲得德國國家認可機構(DAkkS)的認可,可以簽發符合最新版ISO 13485:2016的質量管理體系認證證書。持有現行ISO 13485認證證書的公司需在2019年3月31日前按照新標準進行認證升級。簽發的證書有效期為三年,除非歐盟委員會公布了被取代標準的停用日期。之后,“有效期至”將為失效日期。持有涵蓋較長有效期證書的制造商需要提前籌備并確保在失效之前按照ISO 13485:2016更新。
在專家監管指導下達到要求。填寫表格,下載《醫療器械指導文件:醫療器械驗證流程》。
ISO 13485醫療器械 - 質量管理體系 - 要求出于監管目的,說明了醫療器械制造商和供應商使用的質量管理體系的編制、實施和維護。該標準最初于1990年代制定,詳細說明了質量管理體系符合客戶要求,以及歐盟(EU)、加拿大和全球其他主要地區法規的要求。ISO 13485與ISO 9001涵蓋的范圍和目的類似,但是包含醫療器械方面的其他具體要求,不包括某些ISO 9001條款。因此,在大部分地區,ISO 9001認證并不能取代ISO 13485認證。
在歐盟,ISO 13485的協調化標準已包含以下指令的基本要求:醫療器械指令(93/42/EEC),體外診斷醫療器械指令(98/79/EC)和有源植入醫療器械指令(90/385/EEC)。獲得由授權機構頒發的ISO13485證書,預示著符合這些重要指令基本要求。在美國,美國食品和藥物管理局(FDA)允許醫療器械制造商提交ISO 13485審核報告,作為其質量體系法規合規(QSR)的替代證據。加拿大衛生部還要求在加拿大銷售其產品的醫療設備制造商的質量管理體系通過ISO 13485認證。
TÜV南德產品服務部是全球最大的歐盟公告機構,我們的技術專業人員掌握第一手信息,而且具備各類醫療器械方面的淵博專業知識。另外,我們是全球知名的質量管理體系認證機構,授權范圍囊括適用于醫療器械生產的管理體系。每個審核團隊均由多名具備相關技能和專業知識的專家組成,能準確評估管理體系的合規情況,主任審計員將統籌審核以及任何需要的管理變動通知。最后,您可通過我們的現場或非現場技術文件評審反饋,了解相關的未合規問題情況。這樣獨特的經驗綜合,讓TÜV南德能夠充分地滿足希望獲得或維護ISO 13485認證的醫療器械制造商的需求。
TÜV南德為醫療器械制造商提供完整系列的測試、認證和審核服務,幫助他們管理風險,保護并促進患者、用戶以及其他人員的健康與安全。我們在全球共有700多名專業的醫療健康和服務專業人員,包括知名科學家和醫生,他們都是各自領域內公認的權威人士。這些能力促使TÜV南德成為全球醫療器械法規合規的首選甚至唯一提供商。
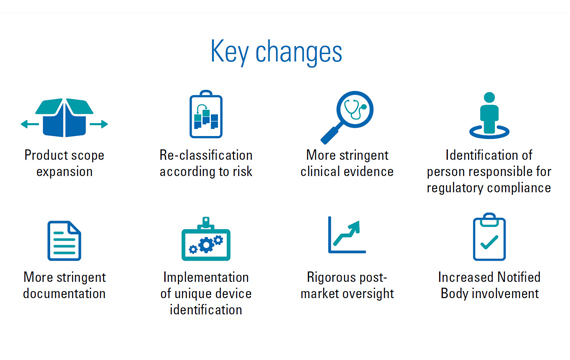
Following the publication of regulation (EU) 2022/112, the IVDR will be rolled out gradually.
Learn More

Site Selector
Global
Americas
Asia
Europe
Middle East and Africa